| 电镀中的阳极可分为两年夜类:一类是电镀中发作氧化溶解,成为金属离子进入镀液,称为“可溶性阳极”,如镀铜、镀镍、镀锌等镀槽中应用的金属阳极,都属于该类;另外一类是正在电流作用下,自身根本没有发作溶解,电极上有氧气、氯气等气体析出,称为“没有溶性阳极”,如镀铬中的铅合金阳极、电化学除了油槽中的铁阳极及其余状况下使用的石墨阳极等。电镀中阳极具备首要作用,如与阴极、镀液独特组成电崩溃系,传导电流;经过阳极金属的电化学溶解增补镀液中放电耗费的金属离子,放弃镀液组成的稳固;采纳象形阳极可以使阴极电流密度散布平均;还可发作影响镀层品质的其余氧化反响,如镀铬液中可将过多的cr3+氧化成cr6+,保障镀层品质等。 正在应用可溶性阳极的镀液中,要维持此中放电金属离子的稳固性,应存正在下列均衡,即 g阳极溶解=g阴极堆积+g泥渣、堆积+g排风带出+g镀件带出 (2—9) 式中g一金属品质。 为完成上述均衡,要求阳极正在肯定电流密度范畴内以肯定速率失常溶解。因为经过阴、阳极的电流强度相反,而工作电流密度没有尽相反,因而消费中通常经过管制阴、阳极的面积比调整。 电镀时,阳极进程比阴极进程复杂患上多,大要可分为阳极的失常溶解以及钝化两种状况。金属阳极失常溶解时,可能蕴含以下步骤:金属晶格的毁坏、电子的转移、重生成金属离子的水化或络合和经过电迁徙、分散、对流等使它们从阳极外表移去。上述各步骤中,金属晶格的毁坏以及电子的转移步骤,可能为速率管制步骤。 依据塔菲尔公式
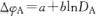 (2—10) (2—10)由电化学步骤管制的阳极溶解进程中,阳极过电位aga与阳极电流密度da成对数关系,合乎电化学极化的塔菲尔公式。 图2—26所示为正在恒电位前提下测患上的阳极极化曲线,此中ab段即为阳极的电化学极 化曲线,合乎式(2-10),正在ab段对应的电位范畴内,阳极失常溶解,外表处于活化状态,称为“失常溶解区”。 金属阳极没有同,替换电流i0的数值亦没有相反,因此阳极极化作用也没有相反(见表2-4)。对少数镀种而言,如sn、cd、ag、pb、cu、zn等,金属阳极替换电流较年夜,以是阳极极化作用普通没有年夜。 若持续极化使电位变正,当抵达某一临界值时(如
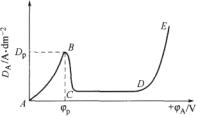
图2—26 阳极极化曲线(恒电位法) b点电位),呈现阳极电流密度急巨变小的景象,称为“钝化景象”,此时阳极外表由活化溶解状态变为简直没有溶的钝化状态。开端阳极钝化的8点电位称为“临界钝化电位”,以%示意,与%相应的电流密度称为“临界钝化电流密度”,以dp示意。 表2-4金属电极替换电流近似值(金属离子浓度/mol·l-1)

bc段,阳极金属外表由活化态转变成钝态,故称“过渡钝化区”。 cd段,金属钝态达到稳固,金属溶解速率降到低值(如0.5mol/l h2s04溶液中,铁阳极钝态溶解电流密度仅为8μa/cm2),且根本没有随电位变动;cd近似为一程度直线,此段称“稳固钝化区”。 到de段,若持续增年夜阳极极化,阳极电流又从新增年夜,多是正在电位很正的状况下,阳极金属以低价离子方式溶解,发作所谓“超钝化景象”,如铬阳极,正在钝化区以cr3+溶解,而正在超钝化区,以cr6+溶解天生铬酸盐;另外一多是发作了其余的阳极反响,如oh一正在阳极放电析出氧气;有时,金属超钝化与氧的析出同时发作,此时阳极电流就相称于两个电极反响速率的总以及。 并不是一切钝化金属都能察看到超钝化景象,如关于那些不克不及构成低价离子的金属,或低价离子只能正在析氧之后能力构成的金属,则没有会发作超钝化。 正在某些阳极体系中,没有存正在de段,cd段的宽度可延长到几十伏以上。 若正在恒电流前提下进行阳极极化,则患上图2—27所示的极化曲线。图中箭头示意极化的标的目的,可见两种极化标的目的上的极化曲线各没有相反,如abcd以及dcef所示,且都没有如恒电位法测患上的曲线完好。 由上可知,若阳极处于失常溶解状态,则合乎电化学步骤的能源学法则;若阳极发作钝化,则没有合乎已钻研过的普通电极进程的法则,属金属阳极进程中的一个特性。 |












