在混合电位emp下非稳态期产生的稳态化学镀铜沉积称之为“诱发期”。 1诱发期 诱发期的定义是达到混合电位开始进行稳态金属沉积所需的时间。可以通过一个简单实验进行测定:将金属试片浸入化学镀液,从浸入时记录金属的电位(或从加入还原剂时开始记录),直至达到混合电位为止。图17—3列出了铜墓体上化学镀铜的典型记录曲线,该体系置于大气中,并在溶液中加入添加剂,诱发期的持续时间相当长[16]. 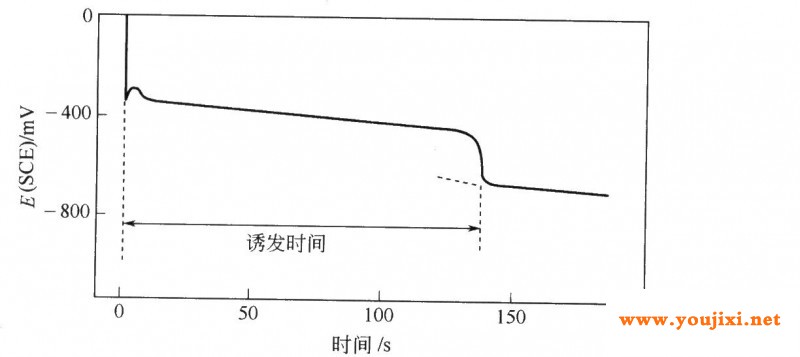 图17—30·3mol/ledta、0.05mol/lcus04、ph值为l2.50、2.5g/l多聚甲醛、铜电极、2.2cm2、25℃、sce参比电极、氩气保护下的诱发期(frompaunovic[16],withpermissionfromtheelectrochemicalsociety) 全过程的诱发期问题可以转化为氧化和还原部分反应的开路电位(ocp)问题,即每个过程的单独诱发期。paunovic[16]研究发现,cu/cu2+体系的ocp可以瞬哼达到,图17—4的典型曲线表示,还原剂的0cp随时间的变化,通过对比这些0cp值,可以推断出还原剂0cp的建立时间。在化学镀铜沉积中,ch20是建立稳态混合电位中的速度控制部分反应。 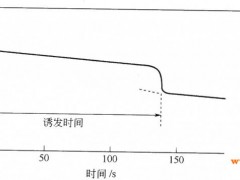 图17—4不同edta含量溶液的开路电位:1g/l多聚甲醛,ph值为l2.50,铜电极,sce参比电极(frompaunovic[16],withpermissionfromtheelectrochemicalsociety) 决定还原剂达到静电位所需时间的主要因素是配位体的类型和浓度以及溶液的ph值[16]。 2稳态动力学 有三种方法可以测量混合电位下化学镀铜的稳态沉积速度,paunovic和vitkavage[26,27]利用混合电位附近的极化数据测量沉积速度[26,z7],ohn0利用交流极化进行测量[28],第3种电化学方法是利用17.1.2节中的evans曲线。ric—c0和martin利用声波仪测量和控制沉积速度[29],提出了测量化学镀铜沉积速度的各种经验公式[4,6]。 3ph值对沉积速度的影响 ph值对化学镀铜的影响有两种方式:,0h-在总反应和部分阳极反应中是反应物[见反应式(17—1)和式(17—7)],因而直接影响这些反应(ph值的主要影响);第二,ph值的影响与金属溶液界面的结构和组成有关[14],其中包括:①吸附;②双层结构;③溶液中铜试样的结构;④溶液的离子浓度。它们间接影响(ph值的次要影响)化学镀铜的沉积速度。 ph值的主要影响可以通过0h-的反应级数以及速度与ph值的曲线来表示,实验测得的速度ph值曲线表明,随着ph值的升高,沉积速度随之加快,达到一个大值后开始下降。图l7—5是化学镀铜沉积速度与ph值关系的一个例子,从图17-5中可以看出,在特定情况(edtp溶液)下,ph值为l2.5时的沉积速度大。开始时沉积速度增加是由ph值的主影响所致,高ph值下速度达到大后下降,是由于ph值的次影响。酒石酸盐镀液在ph值为l2.8时沉积速度大[9],可以认为存在两种次影响:①亚甲基二醇相对浓度的变化,以及由于亚甲基二醇的离解[20]产生0h-改变ph值;②甲醛氧化引起的传质系数变化,从而改变ph值[l5]。  图17—5化学镀铜沉积速度与ph值的关系。化学镀铜液含0.05mol/lcus04、0.15mol/ledtp、0.07mol/l多聚甲醛,用naoh调节ph值,溶液中通人氩气去氧(fromdullyetal.[14].withpermissionfromtheelectrochemicalsociety) paunovic[l5]用数学模型描述了ph值的影响,从该模型可以推断,高ph值处速度达到大后下降是由于ph值受动力学参数ared(还原剂氧化的传质系数,第1章a部分)和i0red(还原剂氧化的交换电流密度,第l章a部分)所引起的,正如以前提出的亚甲基二醇的离解在化学镀铜的沉积中是一个重要因素,但不能充分解释ph值的影响。 4催化 haruyama、ohno[30]和wiese、weili[31]研究了化学沉积铜的催化现象,haruyama和ohn0研究表明,化学沉积中金属对还原剂氧化的催化活性主要由两个反应的速度常数决定,即阴离子团的氧化吸附及脱附(见第l章a部分l.2节)。wiese和weil研究表明,铜在含edta溶液中沉积是由化学吸附的亚甲基二醇离子进行催化。 相关阅读:化学镀铜:阳极部分反应 化学镀铜:电化学模型 化学镀铜:生长机理 化学镀铜:结构 化学镀铜:性能 |












